Наследственный рак молочной железы и яичника: значение диагностики для профилактики и лечения
26.08.2020
Наследственный рак молочной железы (РМЖ) и рак яичника (РЯ) является наиболее распространенным наследственным опухолевым синдромом, то есть генетическим заболеванием, которое значительно повышает риск развития злокачественных опухолей. Генетический скрининг лиц группы риска необходим прежде всего с целью выявления здоровых носителей наследственных мутаций для обеспечения эффективной профилактики и ранней диагностики онкозаболеваний. Выявление наследственных мутаций у онкологических пациентов также очень важно, поскольку влияет на тактику их дальнейшего лечения.
Для диагностики принципиальным является использование метода секвенирования нового поколения (NGS), что позволяет идентифицировать все возможные мутации в генах, ассоциированных с синдромом наследственного РМЖ и РЯ. В этом исследовании 30-генная NGS-панель позволяет выявить наследственные мутации у 33 % (20/61) пациентов с РМЖ или РЯ, тогда как метод полимеразной цепной реакции (ПЦР) — только у 6 % (6/108) пациентов в аналогичной выборке. Таким образом, методом ПЦР можно обнаружить лишь около 15 % наследственных мутаций, следовательно, он неэффективен для скрининга.
Биология наследственного рака
Семейные формы рака наблюдают с давних времен, однако только недавно стали открывать причины повышенной частоты случаев онкологических заболеваний в некоторых семьях. В 1994 г. был обнаружен первый ген, ответственный за развитие
РМЖ — BRCA1 (от Breast Cancer 1, Y. Miki et al., 1994), а через год — еще один, BRCA2 (R. Wooster et al., 1995). Эти гены являются классическими онкосупрессорами и играют важную роль в процессах репарации, то есть исправлении повреждений ДНК, и запускают один из механизмов канцерогенеза (K. Gudmundsdottir, A. Ashworth, 2006; S. A. Narod, W. D. Foulkes, 2004). Существуют два принципиально различных механизма канцерогенеза. Первый заключается в возникновении драйверных мутаций в онкогенах, которые являются стимуляторами роста и размножения клеток. Активирующая мутация в одном аллели онкогена приводит к изменению функционирования клетки и усиления роста и пролиферации, даже при отсутствии мутации в другом аллели. Мутации в онкогенах вызывают развитие спорадического рака и в большинстве случаев являются соматическими, то есть такими, которые возникают в клетках тела (не в гаметах), проявляются только в данном организме но не наследуются. Биологической причиной того, что эти мутации не могут быть наследственными, является то, что даже их гетерозиготное носительство (то есть присутствие одного мутантного аллеля и одного нормального аллеля "дикого" типа — WT) приводит к нарушению функционирования клетки и внутриутробного развития, поэтому организмы с наследственными мутациями в онкогенах должны погибать на ранних этапах эмбриогенеза. Тем не менее было показано, что у 0,5 % пациентов с раком легкого, которые не курили, проявляется наследственная мутацию T790M в онкогене EGFR (N. Girard et al., 2010). Биологическим объяснением такого явления может быть то, что эта мутация является активирующей только в комбинации с другими мутациями EGFR, а не сама по себе. Однако большинство наследственно обусловленных онкологических заболеваний связаны с другим путем канцерогенеза, ключевую роль в котором играют гены — супрессоры опухолевого роста.
На сегодня известно большое количество генов-онкосупрессоров, мутации в которых повышают риск развития определенных видов рака. Наиболее клинически значимыми из них являются BRCA1, BRCA2, TP53, PALB2, PTEN, CHEK2, MLH1, MSH2 и др. Общий принцип этого пути канцерогенеза заключается в том, что наследственная мутация инактивирует один аллель гена, который тем или иным путем предотвращает злокачественную трансформацию клетки. Вторая, нормальная копия гена компенсирует эту потерю, сохраняя нормальное функционирование клеток и организма в целом. Однако в клетках постоянно возникают мутации, и есть высокая вероятность инактивации второй копии гена, что может привести к инициации роста опухоли. В случае генов BRCA1 и BRCA2, которые кодируют белки системы репарации двухцепочечных ДНК, вторая мутация приводит к накоплению ошибок в ней. В основном активируются гены контроля клеточного цикла, которые блокируют дальнейший рост клеток с генетическими аномалиями и индуцируют программируемую гибель клетки — апоптоз. Но мутации могут возникнуть и в генах регуляции клеточного цикла и инициации апоптоза (например, в ТР53), таким образом препятствуя гибели клетки и способствуя дальнейшему повышению генетической нестабильности. На этом этапе остается еще вторая "линия обороны" — система противоопухолевого иммунитета, которая может обнаружить и уничтожить аномальные клетки. Однако учитывая частоту возникновения новых мутаций, количество клеток в организме и продолжительность жизни человека, вероятность развития опухоли у носителей мутаций в генах-онкосупрессорах, несмотря на все защитные механизмы, очень высока.
Эпидемиология наследственного РМЖ и РЯ
Частота носительства мутаций, ассоциированных с высоким риском развития РМЖ и РЯ, довольно высока и повышается при наличии личного и семейного онкологического анамнеза. Наиболее распространенными являются мутации в генах BRCA1 и BRCA2, но носители этих мутаций составляют не более половины популяции повышенного онкологического риска. У остальных этой когорты риск развития рака повышен за счет мутаций в других генах, распространенность которых варьирует в зависимости от популяции (D. Ford et al., 1998; S. Thomas et al., 2002; S. A. Narod, W. D. Foulkes, 2004). Какое же реальное влияние указанных мутаций на риск развития опухоли? Относительно генов BRCA1 и BRCA2, то мутации в них повышают риск развития РМЖ до 87 %, а РЯ — до 50 % в течение жизни (S. Chen, G. Parmigiani, 2007; M.C. King et al., 2003; рис. 1). Также у пациенток с BRCA-ассоциированным РМЖ значительно повышается риск развития второй опухоли (K. E. Malone et al., 2010; К. A. Metcalfe et al., 2005; рис. 2). Генетическое обследование населения главным образом направлено на выявление группы риска, для которой необходим интенсивный скрининг с целью предотвращения или раннего выявления онкологического заболевания.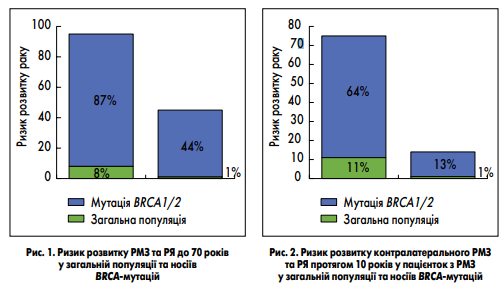 Тактика выявления носителей мутаций
Тактика выявления носителей мутаций
Показания к тестированию на наследственную предрасположенность к РМЖ и РЯ представлены многими международными организациями, в том числе Национальной онкологической сетью США (NCCN). Критерии NCCN для назначения тестирования на выявление генов, ассоциированных с высоким риском развития РМЖ и РЯ:
I. Наличие мутации в одном из генов у кровного родственника.
II. Отрицательный результат предыдущего ограниченного исследования (например, ПЦР BRCA1/2) при наличии критериев для тестирования.
III. Персональный онкологический анамнез:
1. РМЖ при одном из критериев:
a) диагностирован в возрасте ≤45 лет;
b) диагностирован в возрасте 46–50 лет и:
(a) неизвестный семейный онкологический анамнез или:
(1) второй РМЖ в любом возрасте или ≥1 близкий родственник с РМЖ, РЯ, раком поджелудочной или предстательной железы (≥7 по шкале Глисона) в любом возрасте или: i. тройной негативный РМЖ, диагностирован в возрасте ≤60 лет;
c) диагностирован в любом возрасте и:
(a) принадлежность к евреям-ашкенази или:
(1) ≥1 близкий родственник с РМЖ в возрасте ≤50 лет или РЯ, раком поджелудочной или метастатическим раком предстательной железы в любом возрасте или: i. ≥2 случаев РМЖ у близких родственников;
d) рак грудной железы у мужчин в любом возрасте.
2. Эпителиальный РЯ (преимущественно Highgrade серозный), включая рак маточных труб и первичный перитонеальный рак, в любом возрасте.
3. Экзокринный рак поджелудочной железы в любом возрасте.
4. Метастатический рак предстательной железы в любом возрасте.
5. Рак предстательной железы (≥7 по шкале Глисона) и:
a) принадлежность к евреям-ашкенази или:
(a) ≥1 близкий родственник с РМЖ в возрасте ≤50 лет или РЯ, раком поджелудочной или метастатическим раком предстательной железы в любом возрасте или:
(1) ≥2 случаев РМЖ или рака предстательной железы у близких родственников в любом возрасте.
6. В опухоли выявлена мутация, которая имеет клиническое значение, если является герминогенной (наследственной).
7. Для определения терапевтических возможностей, например при HER2- негативном РМЖ.
IV. Семейный онкологический анамнез:
1. Лицо с онкологическим заболеванием или без него с родственником 1–2-й степени родства, что соответствует вышеперечисленным критериям (кроме последнего).
2. Лицо с онкологическим заболеванием или без него, которое не соответствует перечисленным критериям, но имеет вероятность мутации BRCA1/2 ≥5 %, определенную по моделям риска (BRCAPro, Pennll и др.).
Итак, исследования рекомендуется лицам с отягощенным семейным анамнезом, пациентам молодого возраста с первичномножественными опухолями и всем пациентам с РЯ и раком поджелудочной железы.
Методы выявления наследственных мутаций, ассоциированных с высоким риском развития РМЖ и РЯ, и сравнение их эффективности
Спектр генов и разновидностей мутаций, повышающих риск развития РМЖ и РЯ, чрезвычайно широк. Только в генах BRCA1 и BRCA2 на сегодня описано >1800 (https://arup.utah.edu/database/BRCA/Home/BRCA1_landing.php) и >2100
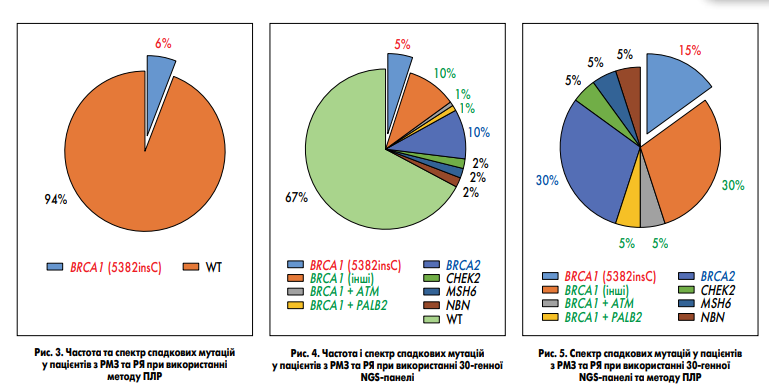
(https://arup.utah.edu/database/BRCA/ Home / BRCA2_landing.php) вариантов, около 94,5 % из них являются патогенными. Но есть мутации, которые встречаются в популяциях чаще других. Так, наиболее частыми являются две мутации в гене BRCA1 (185delAG и 5182insC) и одна в гене BRCA2 (6174delT). Из-за достаточно высокой частоты по сравнению с другими эти мутации были описаны первыми и сначала составляли около 90 % всех описанных наследственных мутаций, ассоциированных с РМЖ и РЯ. Это привело к тому, что в некоторых странах, в частности в Украине, широкое применение получили ПЦР-тесты, которые выявляют эти и некоторые другие мутации. Но в процессе накопления данных проявляли все новые варианты, поэтому доля указанных вариантов во всех носителях наследственных мутаций постепенно уменьшалась и на конец 2000‐х годов составляла всего 20–30 % (L. Zhang et al., 2009). В Медицинской лаборатории CSD было проведено ретроспективное сравнение эффективности применения ПЦР и NGS для выявления наследственных мутаций у пациентов с РМЖ и РЯ. Для этого была отобрана когорта пациентов с РМЖ или РЯ, которым проводилось NGS-исследование с использованием 30-генной панели, и случайную когорту пациентов с РМЖ или РЯ, которым было выполнено ПЦР-тестирование. В ПЦР-когорту вошло 108 пациенток, 103 из которых имели диагноз РМЖ, а 5 — РЯ. Средний возраст пациенток составил 47,5 года. В NGS-когорту вошла 61 пациентка, из которых 49 имели диагноз РМЖ, а 12 — РЯ. Средний возраст в NGS-когорте составил 45,5 года. При ПЦР-исследовании определяли 5 мутаций в гене BRCA1 (4153delA, 5382insC, 185delAG, 3875del4, 2080delA (ins A)) и 1 мутацию в гене BRCA2 (6174delT). NGS-панель включала полноэкзонное секвенирование 30 генов (APC, ATM, BAP1, BARD1, BMPR1A, BRCA1, BRCA2, BRIP1, CDH1, CDK4, CDKN2A (p14ARF), CDKN2A (p16INK4a), CHEK2, EPCAM, GREM1, MITF, MLH1, MSH2 , MSH6, MUTYH, NBN, PALB2, PMS2, POLD1, POLE, PTEN, RAD51C, RAD51D, SMAD4, STK11, TP53). В ПЦР-когорте мутация была обнаружена у 6 пациенток с РМЖ. У всех этих пациенток была определена мутация BRCA1 5182insC. Общая частота мутаций составила 6 % (рис. 3). В NGS-когорте мутации были обнаружены у 20 пациенток, у 5 из них был диагностирован РЯ, а у 15 — РМЖ. Среди мутаций, которые определяются методом ПЦР, в NGS-когорте было выявлено только мутацию BRCA1 5182insC у 3 пациенток с РМЖ, и ее частота составила 5 %. Это соответствует частоте мутации в ПЦР- когорте и указывает на то, что когорты являются сопоставимыми, а их сравнение — корректное.
Кроме указанной мутации BRCA1 5182insC, в NGS-когорте были обнаружены другие редкие мутации BRCA1 — у 10 % (6 пациентов), BRCA2 — у 10 % (6 пациентов), CHEK2, MSH6 и NBN1 — по 2 % (по 1 пациенту). У 2 пациентов были определены по две мутации: BRCA1+ ATM и BRCA1+ PALB2. Общая частота мутаций в NGS-когорте составила 33 % (рис. 4). Таким образом, 30-генная NGS-панель обнаруживает в 5,5 раз больше носителей мутаций по сравнению с ПЦР. При исследовании NGS-когорты методом ПЦР было бы обнаружено лишь 15 % от всех носителей наследственных мутаций (рис. 5). Эти результаты свидетельствуют о крайне низкой эффективности и необоснованности
применения метода ПЦР для скрининга мутаций, ассоциированных с высоким риском развития РМЖ и РЯ.
 Тактика наблюдения здоровых носителей наследственных мутаций
Тактика наблюдения здоровых носителей наследственных мутаций
Скрининг наследственных мутаций в первую очередь важен для здорового населения с целью предотвращения или ранней диагностики онкологических заболеваний. После
получения положительного результата исследования выбор дальнейшей тактики определяется индивидуально, совместно врачом и пациентом. Ответственность за
информирование кровных родственников о своем статусе мутации и их потенциальный риск несет сам носитель мутации. Наиболее подробно тактика снижения риска развития
РМЖ и РЯ разработана для носителей мутаций BRCA1/2. Это объясняется тем, что для указанных лиц накоплен самый большой массив доказательств относительно
эффективности тех или иных процедур. NCCN приводит основные рекомендации по тактике ведения носителей мутаций, повышающих риск развития РМЖ и РЯ (табл.). В
частности процедуры по снижению онкологического риска можно разделить на 3 группы: наблюдение (скрининг), профилактическая хирургия и медикаментозная терапия
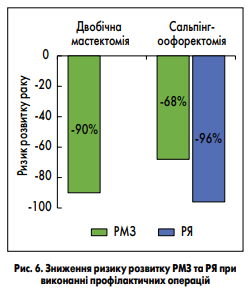
(https://www.nccn.org). Наиболее изученными являются первые две тактики, поэтому более подробно их рассмотрим. Скрининговые процедуры, повышающие раннее выявление РМЖ, включают ежегодное клиническое обследование и магнитно-резонансную томографию (МРТ) молочных желез с 25 лет, а после 30 — МРТ в комплексе с маммографией. Для профилактики РЯ NCCN рекомендует ежегодное трансвагинальное ультразвуковое исследование (УЗИ) в комплексе с определением в крови онкомаркера СА‐125. Однако авторы отмечают, что эта тактика не обеспечивает существенного снижения риска РЯ и рекомендуется только для пациенток, которые отказались от профилактической сальпингоофорэктомии. Высокую эффективность по снижению риска возникновения РМЖ и РЯ продемонстрировали профилактические операции. Так, двусторонняя профилактическая мастэктомия снижает риск развития РМЖ на 90 %, а сальпингоофорэктомия снижает и риск развития РМЖ на 68 % и РЯ на 96 % (SM Domchek et al., 2010; A. Finch et al., 2006; рис. 6). Системное выявление здоровых носителей наследственных мутаций и четкое соблюдение клинических рекомендаций по скрининговым исследованиям очень важны для снижения заболеваемости и повышения ранней диагностики РМЖ и РЯ на общегосударственном уровне.
Значение наследственных мутаций у пациентов с РМЖ и РЯ
Кроме того, что информация о наличии наследственных мутаций важна для здоровых носителей с целью профилактики онкозаболеваний, она также имеет существенное значение для пациентов с РМЖ и РЯ, поскольку влияет на дальнейшую тактику терапии. Во-первых, статус мутаций BRCA1/2 важен для пациентов с РМЖ, которым можно выполнить органосохраняющие операции. Было показано, что риск локальных рецидивов
у носителей мутаций BRCA1/2 при выполнении органосохраняющей операции в несколько раз выше, чем у пациентов, которым была выполнена мастэктомия (Pierce et al., 2010). Кроме того, независимо от вида первой операции, примерно у половины пациентов с BRCA-ассоциированным РМЖ в течение 20 лет развивается контралатеральный РМЖ. Таким образом, пациентам с локальным и местнораспространенным BRCA-ассоциированным РМЖ рекомендуется проведение радикальной операции вместо органосохраняющей, желательно рассмотреть возможность выполнения одномоментной двусторонней мастэктомии во избежание
развития контралатерального РМЖ. Во-вторых, наличие BRCA1/2 влияет на тактику системной терапии при метастатическом РМЖ. Как было описано выше, гены BRCA1/2 входят в систему репарации ДНК, и в наследственно обусловленных опухолях обычно инактивированы оба аллеля гена. Соответственно для таких пациентов должно быть эффективным применение агентов, которые повреждают ДНК (например, препаратов
платины), потому что они будут приводить к накоплению летальных ошибок ДНК в опухолевых клетках. Результаты клинических исследований подтвердили это предположение, и частичный или полный ответ на платиносодержащую терапию наблюдается более чем у 60 % пациентов с мутациями BRCA1/2 (JM Lee et al., 2014; K. Alsop et al., 2012; K. Pennington et al., 2014). Выявление BRCA-ассоциированных опухолей и определение функции BRCA1/2 в клетке побудило к поиску новых терапевтических мишеней среди белков, задействованных в системах репарации ДНК. Такие препараты должны блокировать альтернативный путь восстановления повреждений ДНК и таким образом приводить к быстрому их накоплению и гибели клеток с неактивным BRCA1/2. Первой группой таких препаратов стали ингибиторы поли-АДФ-рибозаполимеразы (PARP), фермента, который задействован в репарации одноцепочечных разрывов ДНК. Эти препараты продемонстрировали свою высокую эффективность при BRCA- ассоциированных опухолях и сегодня одобрены для терапии пациентов с РМЖ и РЯ с мутациями BRCA1/2. Таким образом, выявление здоровых носителей и пациентов с наследственно обусловленными опухолями является чрезвычайно важным для снижения заболеваемости и повышения эффективности лечения РМЖ и РЯ.

Последние новости


