Заметки онколога: Синдром Линча
22.11.2021
Около 20% всех случаев колоректального рака (КРР) носят наследственный характер.
Учитывая высокую распространенность наследственных форм КРР, обязательным этапом первичной диагностики данного вида рака является оценка факторов риска и выявление данных отягощенного семейного анамнеза относительно соответствующих наследственных синдромов, среди которых наиболее часто встречается синдром Линча.
Общая информация о синдроме Линча
Синдром Линча (СЛ) – это наиболее распространенный наследственный синдром, обуславливающий генетическую предрасположенность к развитию КРР, на долю которого приходится 2%-4% всех случаев КРР. В общей когорте пациентов с КРР данный синдром выявляется у 1 из 30 пациентов.
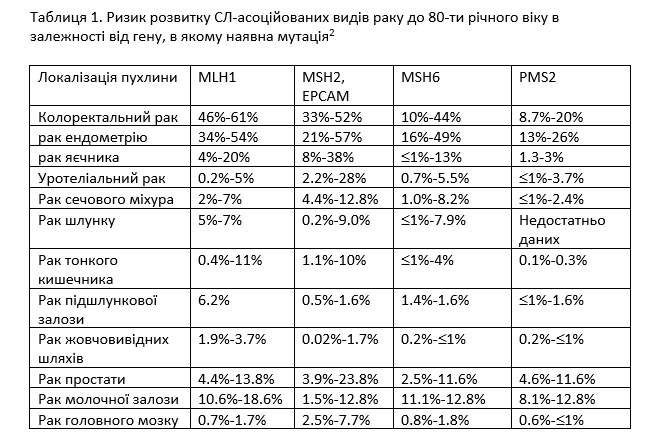
СЛ обусловлен наличием либо наследственных мутаций в одном из 4 генов семейства MMR (MLH1, MSH2, MSH6, PMS2), либо делеций в гене EPSAM подавляющих транскрипцию гена MSH2. Наиболее распространенными СЛ-ассоциированными видами рака являются КРР и рак эндометрия (РЭ). Ассоциированные с СЛ КРР и РЭ характеризуются более ранним возрастом постановки диагноза (до 50 лет), однако могут проявляться и у старших возрастных категорий (Таблица 1).
Хирургическое лечение КРР у пациентов с синдромом Линча
Пациенты с СЛ-ассоциированным КРР, у которых имеются мутации MLH1 или MSH2, находятся в группе повышенного риска развития метахронного КРР. С целью уменьшения риска развития метахронного КРР в данной когорте, при резекционных вмешательствах по поводу первичного КРР вместо сегментальной резекции возможно выполнение колэктомии в расширенном объеме; дальнейший план наблюдения – колоноскопия прямой кишки 1 раз в год. Решения об объеме оперативного вмешательства следует принимать на основе рисков развития метахронного КРР, с учетом прогноза и качества жизни пациента. После сегментальной резекции риск развития метахронного КРР составляет 16%, 41% и 62% через 10, 20 и 30 лет соответственно. По другим данным, после сегментальной резекции данный показатель составлял 20% и 47% через 10 и 25 лет соответственно; после расширенной резекции – 4% и 9% соответственно. Риск развития метахронного КРР снижается на 31% на каждые 10 см удаленного кишечника. Также расширенный объем резекции может выступать в качестве профилактики метахронного КРР у пациентов с СЛ, которые не смогут соблюдать надлежащий план наблюдения после завершения лечения по поводу первичного КРР (колоноскопия 1 раз в год при мутациях MLH1 или MSH2, 2 раза в год – при мутациях (MSH6, PMS2, EPCAM).
Диагностика синдрома Линча у пациентов с КРР
В тех случаях, когда у одного из близких родственников пациента факт наследственной мутации в одном из 5 генов уже установлен, для опровержения или подтверждения диагноза СЛ достаточно выполнить исследования на наследственные мутации в том же гене.
У лиц без информации о соответствующих наследственных мутациях у родственников, на основе критериев семейного анамнеза и в зависимости от изучаемого материала, выделяют два основных пути диагностического алгоритма СЛ:
1) В один этап - определение наследственных мутаций с помощью мультигенной панели, которая включает исследования MLH1, MSH2, MSH6, PMS2 и EPCAM мутаций.
2) В несколько этапов – решение о проведении теста на наследственные СЛ-ассоциированные мутации принимается на основе результатов одного из следующих исследований:
- иммуногистохимическое исследование (ИГХ) на выявление белков 4 MMR генов (MLH1, MSH2, MSH6, PMS2)
- исследование статуса микросателлитной нестабильности (MSI)
- NGS-панель, включающая по меньшей мере 4 MMR гена, гены EPCAM, BRAF, MSI и другие гены ассоциированы с наследственными синдромами при КРР
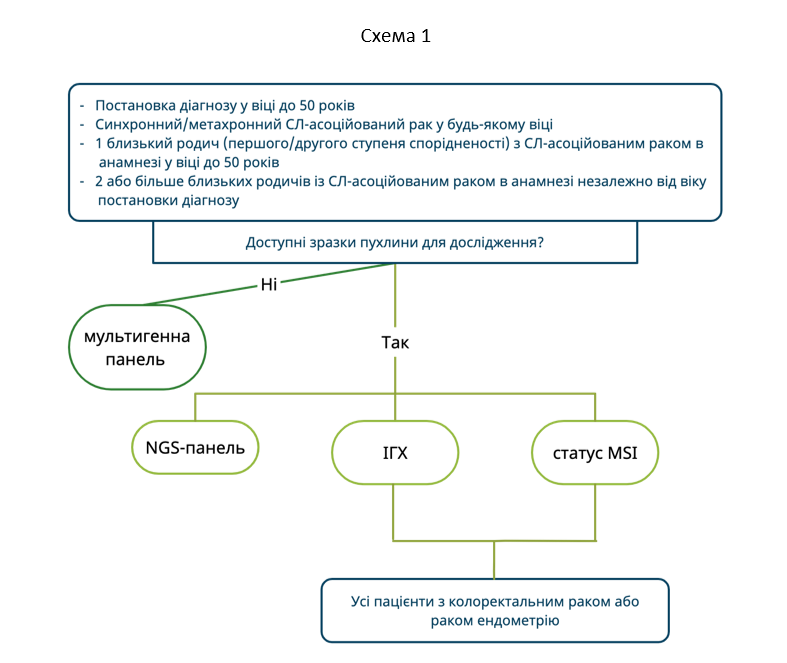
У пациентов с КРР или с раком эндометрия (РЭ) первый путь диагностического алгоритма СЛ (мультигенная панель) может быть вариантом выбора при наличии одного из следующих критериев:
- Постановка диагноза в возрасте до 50 лет
- Синхронный/метахронный СЛ-ассоциированный рак в любом возрасте
- 1 близкий родственник (первой/второй степени родства) с СЛ-ассоциированным раком в анамнезе в возрасте до 50 лет
- Больше 2 близких родственников с СЛ-ассоциированным раком в анамнезе независимо от возраста постановки диагноза
Для диагностики наследственных мутаций ассоциированных с КРР, у пациентов с отягощенным семейным анамнезом или другими факторами, указывающими на высокий риск генетической предрасположенности, предпочтение отдается исследованиям на основе мультигенных панелей, поскольку при более полном генетическом анализе увеличивается вероятность выявить другие, в данном случае не ассоциированные СЛ, наследственные мутации в данной когорте, могут иметь клиническое значение как для пациентов, так и для их родственников.
Второй путь диагностического алгоритма также может быть вариантом выбора у пациентов, отвечающих вышеперечисленным критериям. Кроме этого, диагностика СЛ в несколько этапов (первое исследование либо ИГХ, либо MSI) выступает в качестве скринингового исследования у пациентов с КРР или РЭ (Схема 1).
Скрининг СЛ является «универсальным», то есть ИГХ или определение MSI следует проводить всем пациентам с КРР/РЭ, поскольку чувствительность критериев для выявления пациентов повышенного риска составляет 82%. Скрининг СЛ показан всем пациентам с КРР/РЭ независимо от возраста постановки диагноза. Несмотря на то, что манифестация СЛ-ассоциированных видов рака, в большинстве случаев, происходит до 50 лет, КРР/РЭ, обнаруженные в более старшем возрасте, также могут быть связаны с СЛ. При проведении скрининговых исследований только в когорте пациентов с КРР до 50 лет, СЛ не будет диагностирован более чем в половине случаев. Альтернативным методом скрининга у пациентов с КРР старше 70 лет является проведение соответствующих исследований только тем пациентам, которые отвечают вышеуказанным критериям.
По результатам одного из скрининговых исследований второго диагностического алгоритма о возможном наличии наследственных мутаций в MMR генах свидетельствует одно из следующих:
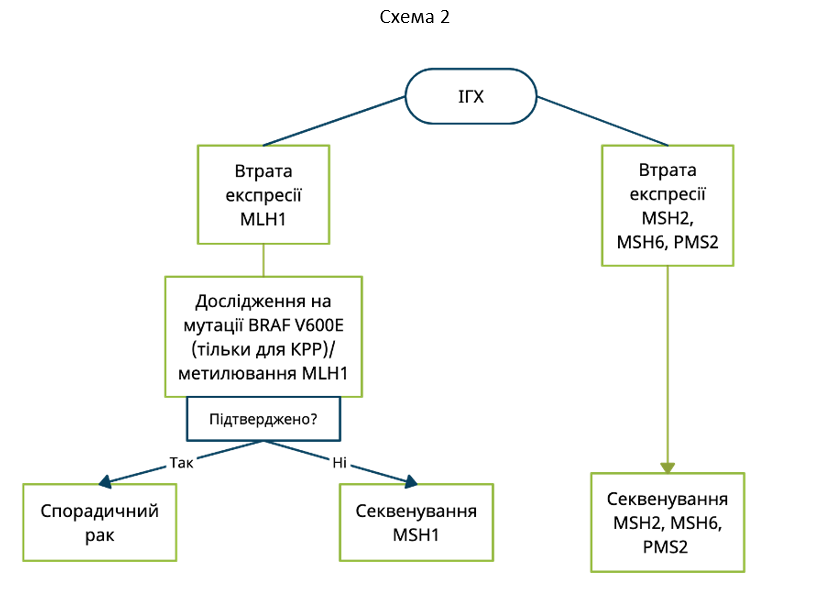
- ИГХ: отсутствует экспрессия одного из 4 белков (свидетельствует о дефекте в одном из MMR генов – dMMR)
- Статус MSI: высокая степень микросателлитной нестабильности (MSI-H)
Каждое исследование (ИГХ или MSI) может быть использовано в качестве первого этапа скрининга СЛ и пока нет общеприемлемого консенсуса относительно того, какой из них следует отдавать предпочтение. MSI-H является критерием для назначения иммунотерапии пациентам с метастатическим КРР и может выступать в качестве фактора риска при назначении химиотерапии на ІІ стадии заболевания. В то же время, результаты ИГХ помогают более точно определить когорту пациентов, которым показано проведение последующих исследований на наследственные СЛ-ассоциированные мутации.
Потеря экспрессии MLH1 и/или PMS2 на ИГХ может указывать на метилирование гена MLH1 (мMLH1). мMLH1 встречается в 10–15% случаев спорадических форм КРР. Для опровержения или подтверждения мMLH1 возможно проведение или исследование опухоли на BRAF мутации (только для КРР), или проведение тестирования на мMLH1. Наличие BRAF мутаций и/или мMLH1 исключает наличие наследственных СЛ-ассоциированных мутаций – в таких случаях нет необходимости в проведении дополнительных генетических исследований (Схема 2).
Исследование опухоли с помощью NGS-панели позволяет получить наиболее полноценную информацию по всем возможным показателям, которые могут указывать на наличие наследственных мутаций. Однако, в качестве скрининга, данное исследование не является экономически выгодным. NGS-панель может быть вариантом выбора у пациентов с КРР, которые отвечают вышеуказанным критериям диагностики СЛ.
Последним этапом второго диагностического алгоритма СЛ является исследование на наследственные СЛ-ассоциированные мутации, которое может осуществляться либо посредством секвенирования выборочных генов (MLH1, NSH2, MSH6, PMS2, EPCAM), либо посредством мультигенной панели (у пациентов с отягощенным семейным анамнезом).
Автор: Мария Билыч, врач-онколог, член Украинского союза клинической онкологии
1. Al B. Benson, Venook AP, Al-Hawary MM, Mwanzi SA, Al EN et. Colon Cancer Colon Cancer. NCCN Harmon Guidel Sub-Saharan Africa - Colon Cancer. 2018;Version 2.(Colon Cancer):1-5.
2. Burke CA, Dallas S. Genetic / Familial High-Risk Assessment : Colorectal. Published online 2021.
3. Mehta SR et al. Screening for the Lynch Syndrome (Hereditary Nonpolyposis Colorectal Cancer). New England Journal. N Engl J Med. 2015;687-696. doi: 10.1056/NEJMoa043146
4. Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut. 2020;69(3):411-444. doi:10.1136/gutjnl-2019-319915.
5. Parry S, Win AK, Parry B, et al. Metachronous colorectal cancer risk for mismatch repair gene mutation carriers – the advantage of more extensive colon surgery 2013;60(7). doi:10.1136/gut.2010.228056.
6. Renkonen-Sinisalo L, Seppälä TT, Järvinen HJ, Mecklin JP. Subtotal Colectomy for Colon Cancer Reduces the Need for Subsequent Surgery in Lynch Syndrome. Dis Colon Rectum. 2017;60(8):792-799. doi:10.1097/DCR.0000000000000802
7. Gudgeon JM, Belnap TW, Williams JL, Williams MS. Impact of age cutoffs on a lynch syndrome screening program. J Oncol Pract. 2013;9(4):175-179. doi:10.1200/JOP.2012.000573
Последние новости


